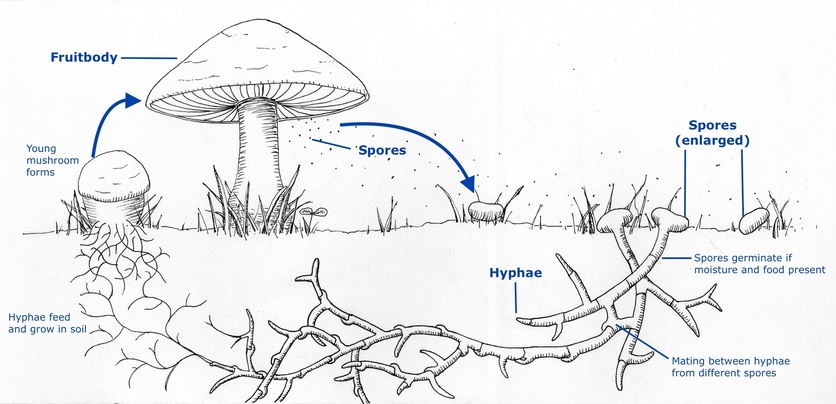
هاگ چیست؟ هاگ قارچ یا اسپور قارچ (spore)، ساختار تولید مثل گونه زیستی قارچها است که وظیفه تکثیر و بقای نسل قارچ را به عهده دارد. جواب سوال هاگ قارچ یا اسپور قارچ چیست به طور ساده، در واقع میتوان به زبان عامیانه گفت که اسپور یا هاگ همان تخم قارچ میباشد.
هاگ قارچ چیست؟
هاگ قارچ یا اسپور قارچ چیست؟ هاگها در حقیقت ارگانهای بسیار ریز و کوچکی از اجتماعات قارچی هستند که اغلب در اندامهای اختصاصی تولید میشوند. توانایی و پتانسیل ایجاد اجتماعات و تودههای جدید و مستقل از قارچهای اصلی و حتی دور از پایههای مادری خود را دارند.
البته فقط قارچها، هاگ (اسپور قارچ) تولید نمیکنند، بلکه در چرخه زندگی بسیاری از گیاهان، گونههای متنوع قارچها، تکسلولیها، جلبکها، گیاهان و باکتریها، و برخی پروتوزوآ و باکتریهای گرم مثبت، نیز اسپور(هاگ) وجود دارد. آنها در هاگدانها قرار دارند که معمولاً به صورت تجمعی رویت میشود و به این اجتماع سور (sori) میگویند. سور توسط ساختاری به نام ایندوزی (endusium) محافظت میشود.
اسپور قارچ چیست؟(هاگ قارچ چیست؟)
آناتومی هاگ یا اسپور قارچ چیست؟
ابعاد هاگها عموما میکروسکوپی است و بنابراین با چشم غیرمسلح قابل مشاهده نیستند. آناتومی اصلی آنها از یک سلول واحد تشکیل می شود که توسط دیواره سلولی محصور شدهاست. در داخل هاگ، مواد ژنتیکی، سیتوپلاسم، آنزیمها، اسیدها و ریبوزومها قرار دارند.
هاگ دارای دیوارهای دولایه است که لایه خارجی، بیرونه (exine) و لایه داخلی، درونه (intine) نام دارد. بیرونه دارای دو لایه است که خارجیترین اکتین یا sexine-syn و داخلیترین انتین یا nesine-syn نام دارد. لایه خارجی بیرونه یا اکتین دارای تزیینات مختلفی است که این تزیینات مربوط به برآمدگی اکتین است. این الگو نقش مهمی در علم تاکسونومی دارد.
رنگ اسپورها از سفید تا سبز، زرد، قرمز، قهوهای و یا سیاه تغییر میکند و در رنگهای بسیار متنوع در طبیعت وجود دارند.

هاگ چگونه به وجود میآید؟
هاگ یا اسپور قارچ که به عنوان واحدهای تولید مثل، در بدن برخی موجودات زنده (از جمله قارچ) نقشآفرینی میکنند، در فرآیندی به نام هاگزایی یا هاگسازی، از طریق سلولهای رویشی به وجود میآیند.
تشکیل هاگها در موجودات مختلف متفاوت است. به عنوان مثال، هاگها در قارچها در ساختارهای ویژهای به نام میوه تولید میشوند که تولیدمثل هاگ را آغاز میکنند. اسپورانژیوم یکی از اندامهای باردهی قارچها است. در باکتریها و مخمرها، هاگزایی زمانی آغاز میشود که این موجودات سعی میکنند خود را با شرایط محیطی جدید وفق دهند. در این فرآیند، اگر شرایط خیلی شدید شود، هاگها از طریق میوز تشکیل میشوند. اسپور قارچ چیست؟
تشکیل اسپور
قارچها عمدتا از طریق تشکیل اسپورها تکثیر مییابند. اسپورها وقتی در شرایط مساعد قرار میگیرند رشد یافته و لولهای به نام لوله تندش (germtube) ایجاد میکنند و رشد هیف از بخش انتهایی لوله تندش انجام میگیرد.
اسپورها در قارچهای آبزی دارای تاژک هستند و دیواره سلولی نازکتری دارند؛ در صورتیکه در قارچهای خشکیزی، دیواره سلولی ضخیمتر بوده و ممکن است از سه لایه آندوسپور، اپی اسپور، پری اسپور تشکیل شود. از نظر ساختمان سلولی شبیه به سایر سلولهای قارچی بوده دارای هسته، میتوکندریهای بزرگ، شبکه آندوپلاسمی، واکوئل و مواد غذایی ذخیرهای در فرم گلیکوژن و چربی دارند.
اسپورها معمولا در داخل محفظهای به نام اسپورانژیوم تشکیل میگردند. اسپورانژیومها روی هیف تخصص یافتهای به نام اسپرانژیوفور قرار میگیرند.
نقش هاگ یا اسپور قارچ چیست؟
اسپورها با تولید افراد جدید تداوم نسل را تضمین میکنند. پس از بالغ شدن موجود، هاگها آزاد و از والد پراکنده میشوند و رشد میکنند یا به افراد جدید جوانه میزنند هاگهای آزاد شده میتوانند هاگهای غیرجنسی یا جنسی باشند. هاگهای غیرجنسی از طریق میتوز تشکیل میشوند و خلقت آنها برای پراکندگی مناسب است؛ در حالی که هاگهای جنسی از طریق میوز تشکیل میشوند. اسپور قارچ چیست؟
هاگها همچنین میتوانند به عنوان وسیلهای برای بقا در شرایط محیطی سخت، از ژنوم ماده محافظت کنند. این گونه هاگها تا زمانی که شرایط مساعد برای بقای آنها فراهم شود، غیرفعال میمانند و در نتیجه ماده ژنتیکی حفظ میشود. این پدیده در باکتریها بسیار رایج است.
تکثیر و نقش هاگ قارچ چیست؟
از آنجایی که در مقوله انتشار و پراکنش برخی از هاگ قارچها، شتاب تنها در حدود چند سانتیمتر در هر ساعت است و چون هیچ موجود زنده تک سلولی تنها در یک خط مستقیم شنا نمیکند و ذخایر انرژی آن نیز تنها چند ساعت دوام میآورند، فاصله و مسافت حرکت بسیار اندک است.
انتقال هاگها در مسافتهای بیش از یک متر مکانیزمهای دیگری را میطلبد که به خوبی توسط mycete ماده نمایان است پراکندگی و تکثیر و انتشار علیرغم موفقیت ظاهری تولید هاگ همانطور که در نمونه پنیسیلیوم یا اسپرگیلاس نشان دادهشد تنها بهطور متوسط و معتدل کافی و مفید است.
در صورتی که به تودههای فراوان هاگهای مورد نیاز برای ضمانت بقای گونهها توجه شود، غیر منتظره نیست که وسایلی جهت افزایش موفقیت در تجمع اجتماعات زمینههای جدید با بهبود انتقال مقصدیابی و روشهای دستیابی به این زمینهها توسعه داده شوند میتوان با تراشیدن سطح هاگها شروع کرد.
زگیلها یا برآمدگیها و دیگر دنبالهها اصطکاک در برابر هوا (یا آب برای قارچهای آبی) را افزایش میدهند و بنابراین بر حفظ توده شدن هاگها در میانه محیط کشت کمک میکنند. دنبالهها یا چسبندگیها همچنین به چسبیدن هاگها بر رویه و سطح خارجی یک گیاه یا میزبان حیوان یا دیگر زمینهها کمک میکند.
هاگ ها چگونه طبقه بندی میشوند؟
هاگها را میتوان بر اساس عوامل مختلفی طبقهبندی کرد که شامل موارد زیر است:
- تحرک: برخی از هاگها میتوانند با استفاده از تاژک حرکت کنند. به این نوع هاگها زئوسپور میگویند. برخی ممکن است تاژک داشته باشند اما نتوانند حرکت کنند. به این نوع هاگها آپلانوسپور میگویند. برخی از هاگها دارای تاژک نیستند و بنابراین غیر متحرک هستند. به این نوع هاگها اتوسپور میگویند.
- اندامهای میوه دهی: بدنهای میوهای مختلف انواع مختلفی از هاگها را تولید میکنند. به عنوان مثال، بازیدیاها بازیدیوسپور تولید میکنند، کونیدیوفورها توسط کنیدیها، آسکوسپورها توسط آسک، تلیوسپورها توسط تلیم و اوسپورها توسط اوگونیا تولید میشوند.
- عملکرد: هاگهای مختلفی را میتوان برای عملکردهای مختلف تولید کرد: برخی برای پراکندگی و برخی دیگر برای بقا هستند. اندوسپورها عمدتاً برای بقا و دیاسپورها برای پراکندگی تشکیل میشوند. برخی از هاگها هم به ویژه در باکتریها صرفا برای ایجاد عفونت آزاد میشوند.
- اسپوروژنز: تشکیل هاگ میتواند از طریق میتوز یا میوز رخ دهد. میوسپورها از طریق میوز و میتوسپورها از طریق میتوز تشکیل میشوند. علاوه بر این، برخی از هاگهای هاپلوئید توسط گامتوفیت والد در گیاهان عالی تشکیل میشود. این گونه هاگها عبارتند از میکروسپورها و مگاسپورها.
چند نوع هاگ یا اسپور وجود دارد؟
انواع مختلفی از هاگ وجود دارند که از ارگانیسمی به موجود دیگر متفاوت است. انواع هاگها عبارتاند از: اسپورانژیوسپور، کلامیدوسپور و آتروسپور
آنها عبارتند از:
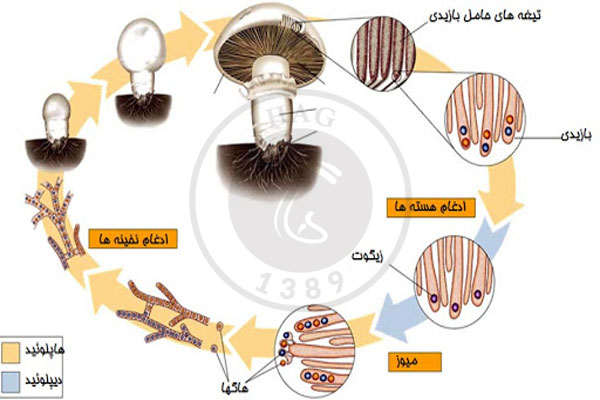
- هاگ جنسی: از طریق میوز تولید میشوند و شامل اتحاد دو هسته میباشند.
- هاگ غیرجنسی: از طریق میتوز تشکیل میشوند.
- هاگ رویشی: آنها با تمایز مستقیم میسلیوم تشکیل میشوند، یک مثال شامل کلامیدوسپورها است.
- مگاهاگ: این هاگها در ژیمنوسپرمها و آنژیوسپرمها رایج هستند. مگاسپورها به گامتوفیت ماده جوانه میزنند.
تمایز موجود بین اسپور قارچ چیست
بدیهی است که چنین تعریف گستردهای از هاگ نیاز به دسته و گروهبندیهای متعدد آنها بر اساس نوع، شکل و عملکردشان ضروری میکند. اساساً تمایز و اختلافاتی بین هاگها وجود دارد. هسته برخی از هاگها (نظیر ascospore یا basidiospore) محصول تقسیم سلولی است و برخی دیگر توسط تقسیم غیرمستقیم تولید میشوند.
باید به یاد داشته باشیم همانگونه که در ascomycete چهار هاگی و یا در basidiomy دو هاگی نشان میدهند، تقسیم سلولی هاگها همواره تک هستهای نیستند و یا برای پراکندگیهای وسیع و گسترده تولید نمیشوند. با وجود این بر حسب نقش اکولوژیکی، این استثناها را نادیده میگیریم.
حرکت بینقص در آب بدلیل مکانیسم و قابلیت شنای برخی از هاگ قارچها سبب میشود آنها به زمینهها و اقلیمهای جدید برای تکثیر هرچه بیشتر دست یابند. با وجود این در دراز مدت این توانایی ناکافی میشود و انتشار قارچ توسط آب محدود و شناور شدن به شکل ناموثری از انتقال گسترده هاگ این قارچها در طبیعت تبدیل خواهد شد.
تولید مثل قارچ ها
قارچها به طریق غیرجنسی و جنسی تکثیر مییابند. در ادامه به شرح این دو نوع تولید مثل در قارچها میپردازیم.
تولید مثل غیرجنسی
تولید مثل غیرجنسی در قارچها رایجتر بوده در صورتی که تولید مثل جنسی ممکن است فقط یک بار در سال اتفاق بیافتد. در تولید مثل غیرجنسی تلفیق هستهها صورت نگرفته و نوترکیبی به وجود نمیآید.
در تکثیر غیر جنسی فرزندان خیلی شبیه به سلول مادری خواهند بود. اما در تولید مثل جنسی تلفیق گامتها الزامی بوده؛ به این صورت که ترکیب گامتها صورت میگیرد و با تلفیق هستهها، نوترکیبی ژنتیکی صورت میگیرد. بنابراین نتایج از نظر ژنتیکی از والدین خود متفاوت هستند.
تولید مثل غیر جنسی، روشها و راههای مختلفی را برای بروز و ظهور دارد که میتوان به موارد زیر اشاره کرد:
قطعه قطعه شدن
در اثر قطعه قطعه شدن ریسه، قطعات هیف یا ریسه در شرایط مطلوب رشد کرده و نسل جدیدی را به وجود میآورند. این روش در طبیعت بسیار رخ میدهد. همچنین برای تکثیر قارچها در آزمایشگاه از این روش استفاده میشود.
جوانه زدن
روش جوانه زدن در مخمرها بسیار رایج است. هنگام جوانه زدن، یک برآمدگی در یاخته مادر، بر اثر کشیده شدن دیواره یاختهای، به وجود میآید. هسته به دو نیم تقسیم و یک نیمه آن وارد جوانه میگردد. جوانه یا یاخته دختر به وجود میآید سپس از یاخته مادر جدا میشود. در بعضی موارد، جوانه از یاخته مادر جدا شدن و خود به همان طریق مذکور جوانه دیگری را ایجاد میکند.
تقسیم دو تایی
این روش تولیدمثل در باکتریها متداول است. ولی در بعضی از مخمرها تکثیر به صورت تقسیم دوتایی انجام میشود. در این روش، یاخته مادر به دو یاخته دختر مبدل میگردد.
تکثیر به وسیله اسپور ها
متداول ترین نوع تولید مثل غیر جنسی، در قارچها تولید هاگ است. در تعریف به هر ذره کوچک زایشی که از هیف یا از یاخته مولد اسپور، جدا شود و به نسل جدیدی از قارچ تبدیل شود، هاگ یا اسپور گفته میشود.
در تولید مثل جنسی حضور گامتها الزامی است. گامتها معمولاً در داخل ساختمانهایی به نام گامتانژ تشکیل میگردند. اگر گامتها از یک ریسه حاصل شوند چنین قارچهایی را هموتالیک گویند. ولی به گامتهایی که از هیفهای مختلف نتیجه میگردند، هتروتالیک میگوییم.
یکی شدن گامتها در سه مرحله انجام میگیرد:
- پلاسموگامی (اتحاد پروتوپلاسمهای سلولی)
- کاریوگامی
- اتحاد کروموزومها یا ژنها

تکثیر جنسی یا کشت اسپور قارچ چیست؟
هاگ خالص به منظور تهیه اسپان مورد نیاز برای تکثیر قارچ خوراکی را به دو روش میتوان تهیه نمود. کشت هاگ، که به نوعی میتوان آن را تکثیر جنسی نامید و دارای تفریق صفات و تنوع بالای نتایج حاصله از نظر کیفیت و کمیت محصول است.
از این روش بیشتر برای تهیه اسپان قارچ استفاده میشود. روش دوم کشت بافت زنده یا به اصطلاح تکثیر غیر جنسی و یا کلونینگ” است . این روش به علت شباهت بالای نتایج تولیدی با والدین، بیشتر در تکثیر قارچهایی که از نظر کیفیت و کمیت محصول در حد مطلوبی هستند استفاده میشود. پرورش دهندگان قارچ، کشت هاگ را به دلیل راحتی اجرا و ماندگاری بالای هاگها حتی تا ماهها بعد از تجزیه کلاهکها ترجیح میدهند. اما ماندگاری کلاهکها یا بافت زنده بسیار کم است (۱ تا ۲ روز) و باید بلافاصله بعد از برداشت بافت، اقدام به کشت نمود.
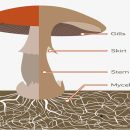
چگونه هاگ قارچ یا اسپور را از قارچ سالم بهدست آوریم؟
مرحله اول در کشت هاگ، جمعآوری مقداری هاگ (نقش اسپور) از قارچهای سالم و مناسب میباشد. بدین منظور کلاهک سالم، تازه و کاملاً تمیزی را از ساقه جدا کرده و بهطور واژگون روی یک کاغذ سفید یا سطح شیشهای تمیز (اسلاید میکروسکوپ) یک تا دو ساعت میگذاریم.
چنانچه کلاهک موردنظر خشک باشد، جهت رهاسازی آسانتر هاگ یک دو قطره آب مقطر به آن میزنیم و برای جلوگیری از کاهش تبخیر و جریان هوای مستقیم، یک بشر بر روی آن میگذاریم پس از چند ساعت که هاگها، کاملاً رها شد و نقش تیغهها روی کاغذ افتاد، کاغذ هاگها را برش از وسط تا میزنیم و در یک ظرف کاملاً در بسته می گذاریم و روی آن را بر چسبی حاوی زمان جمع آوری، گونه قارچ و شماره جمع آوری میزنیم.
در صورت جمعآوری هاگها روی لامل میکروسکوپ، کافی است هاگها را ما بین دو لامل قرار میدهیم دور تا دور لبه این دو لامل را با نوار چسب بچسبانیم تا از نفوذ هاگهای آلاینده، ایمن شود در صورتی که در جمعآوری و نگهداری هاگها دقت کافی نشود، محیط کشت هاگ آلوده میشود و امکان دستیابی به یک کشت خالص نیز کاهش مییابد.

انتخاب نمونه سالم از قارچها
قارچهای دکمهای و سیلوسب و بسیاری دیگر از گونههای خوراکی، در ایام جوانی دارای یک غشاء نازک موسوم به پرده کوچک میباشند. این پرده از لبه کلاهک تا ساقه کشیده شده و از هاگها در برابر شرایط نامساعد محیطی و آلایندهها حفاظت میکند.
هنگام انتخاب نمونه سالم و جوان سعی کنید قارچهایی را انتخاب کنید که پرده آنها پاره نشده باشد، که در این صورت میتوانید با برداشتن دقیق و استریل این پرده به هاگهای خالصتری دست یابید.
تکنیکهای تلقیح و جوانه زنی هاگ قارچ چیست؟
پس از تهیه هاگهای لازم و مطلوب میتوان کشت هاگ را آغاز کرد. بدین ترتیب که ابتدا حلقه تلقیح با تیغ جراحی را با حرارت شعله به مدت ۵ تا ۱۰ ثانیه استریل کرده سپس آن را داخل یک پتری دیش حاوی محیط کشت استریل فرو کرده و میگذاریم کمی خنک شود.
جوانه زنی
آنگاه بهوسیله آن، هاگها را کمکم از روی کاغذ برداشته و بهصورت خطخط یا زیگزاگ بر روی سطح آگار پخش مینماییم. جهت افزایش شانس موفقیت جوانهزنی هاگها، میتوان بهطور همزمان و سریع سه پتری دیش را با هم تلقیح کنیم که به این روش اصطلاح کشت چندگانه یا تودهای هاگ می گویند.
به مرور زمان که از تلقیح میگذرد، هاگها رطوبت جذب کرده متورم میشوند و درصد جوانهزنی آنها افزایش مییابد. چنانچه به رطوبت کافی دست نیابند، چروکیده و به سهولت جوانه نخواهند زد که در این حالت میتوان با مرطوب کردن هاگهای خشک با آب استریل، جوانه زنی آنها را بهبود بخشید.
برای مرطوب سازی هاگها، بهتر است از ابزار مناسب همچون قطرهچکان چشمی، پیپت یا سرنگ آمپول، یک لوله آزمایش پر از آب مقطر یا یک فلاسک ارلن مایر به حجم ۲۵۰-۲۵ سانتیمتر مکعب که درب آن را با پنبه بسته و روی آن را با یک فویل آلومینیومی کاملاً مسدود نمایید.
در شرایط 0/۷ کیلوگرم بر سانتیمتر مربع و به مدت ۳۰ دقیقه با دمای ۱۲۱ درجه سانتیگراد کاملاً استریل شدهاند استفاده کنید. بعد از این مرحله با دقت مقداری هاگ را با تیغ جراحی استریل از محیط کشت بردارید و درون آب مقطر بریزید، آن را محکم ببندید و ۶ تا ۱۲ ساعت در مکانی ساکن بگذارید.
پس از این مدت، چند میلیلیتر از این محلول را با قطره چکان استریل بردارید و چند پتری دیش را با یکی دو قطره از آن، تلقیح کنید و آماده مراحل بعدی باشید.
خصوصیات میسلیوم قارچ خوراکی بعد از جوانه زنی
۳ تا ۷ روز بعد از تلقیح، هاگها شروع به جوانهزنی کرده و بصورت رشتههای سلولی نخ مانند (هیف) منشعب از یک نقطه مرکزی در سطح محیط کشت ظاهر میشوند و به سرعت با گسترش این رشتهها و درهم رفتن آنها، شبکه میسلیومی بوجود میآید.
شبکه میسلیومی در ابتدا به صورت غیرمستقیم و به رنگ خاکستری بوده و بعد از مدت بسیار اندک با تقسیم و تکثیر هیفهای بیشتر و گسترش آنها درون محیط کشت، به رنگ سفید در میآیند.
رنگ میسلیوم اکثر گونهها بویژه دکمهای، شیتاکه، قارچ رقیب کلاهکدار، پانالوس و سیلوسب خاکستری مایل به سفید است. در گونه های دیگر همچون lepista nuda آبی مایل به ارغوانی و گونهای خاص از سیلوسب، قهوهای میباشد. در مجموع، تنوع رنگ تابع نژاد قارچ، روش تکثیر و محیط رشد است.
از دیگر خصوصیات ظاهری میسلیوم میتوان به نوع رویش آن اشاره کرد که از این نظر به انواع مختلف هوایی، مسطح، پنبهای یا ریشه مانند رویت میشود میسلیوم هوایی در گونههای مرطوبزی نمایان میشود، حال آن که میسلیوم مسطح، بیشتر در شرایط خشک رویت میشود.
چگونه کلونی ایجاد می شود؟
به رشد میسیلیوم از محل تلقیح واحد و ظهور انواع انشعابات مختلف الشکل را در اصطلاح، کلونی یا پیکربندی میگویند. هر کلونی را تنها در مقایسه با کلونی میسلیومی مجاور آن میتوان تشخیص داد. انواع عمده کلونیهای میسلیومی عبارتاند از: ریشهای و پنبهای. البته نوع حد واسط این دو نوع نیز وجود دارد.
بدین ترتیب که مثل ریشهای به شکل شعاعی میروید اما بر خلاف آن به هم تابیده و ضخیم نبوده که خطی و تار مانند است. میسلیوم ریشهای بیشتر مستعد تولید پریموردیوم است، میسلیوم خطی نیز توان تولید پریموردیوم فراوان را دارد اما باید به شکل ریشهای تبدیل شود.
کلونیها عموما در محیطهای کشت قارچ رویت میشوند و هر چند اطلاعات ما درباره علت پیدایش و کارکرد آن کم است. اما بدیهی است که ژنتیک، تغذیه و سن میسلیوم نقش مهمی ایفا میکنند. پس از شناخت نوع میسلیوم، بایستی قسمت رویان هاگها را به ظروف کشت جدید منتقل نمود.
دستیابی به کشت خالص از آلودگی ها
پرورشدهنده، به طور انتخابی میسلیومهای خوب و بد را از همدیگر جدا کرده و بعد از مدتی کوتاه به کشت خالص و عاری از هر گونه آلودگی دست مییابد. در این مرحله نیز چنانچه آلودگی اندکی به چشم بخورد، بهتر است آن را از کلونی قارچ جدا کرد. با توجه به این که بسیاری از آلودگیهای متداول، ناشی از کپکهای هاگزا هستند، لذا باید مراقب بود تا محیط کشت را تکان نداده و یا کاری نکرد که باعث انتشار هاگهای این قبیل قارچها گردید.
همچنین باید از خنک بودن تیغ جراحی قبل از ورود آن به درون محیط آگار اطمینان حاصل کرد. زیرا یک تیغ و یا هر گونه وسیله داغ که به داخل آگار وارد میشود، باعث تولید بخار ناگهانی درون پتری دیش و در نتیجه موجب رهاسازی هاگ کپکهای مجاور میشود.
نتایج کشت توده ای یا چندگانه هاگ قارچ چیست؟
همانطور که قبلا به آن اشاره کردیم در صورت عدم امکان تولید نژادی صددرصد خالص میتوان با تهیه چندین کشت هاگ به سادهترین صورت ممکن، یک نژاد نسبتا سالم و در خور استفاده تولید کرد. در صورت جوانهزنی چنین توده هاگ، در واقع نژادهای متنوعی تولید میشود که بعضی از آنها با دیگران سازگاری نداشته و هر یک از آنها در شرایط مصنوعی آزمایشگاهی به لحاظ روش و مقدار محصول تفاوت زیادی با هم خواهند داشت .
چنین ترکیب غیر یک دست ژنتیکی میتواند، بر کل عملکرد آن تاثیر محدود کنندهای داشته باشد. به این ترتیب که نژادهای کمبازده مانع فعالیت نژادهای پربازده دیگر میشوند. به طور کلی تنوع نژادی نتاج حاصل از کشت هاگ بالا بوده اما از نظر رفتاری، این گونه نتاج شباهت زیادی به والدین خود دارند. لذا چنانچه والدین آن اهلی و در شرایط آزمایشگاهی عملکرد خوبی داشته باشند، انتظار میرود که نتاج آنها نیز اینگونه رفتار کنند.
در مقابل، گونههای وحشی در شرایط آزمایشگاهی ممکن است عملکرد بسیار کمی داشته باشند. لذا در مورد آنها باید انتخاب (انفرادی یا تودهای) صورت گیرد و در نتیجه تنها اقدام به کشت گونههای پر محصول و خوب کنیم.
از بین تعداد کثیری از نژادهای تازه ایجاد شده در کشت تودهای هاگها، ممکن است تنها اندکی از آنها قادر به رشد رویشی باشند. هر چند میسلیوم چنین قارچهایی قادر به جذب مواد غذایی و آب میباشند. اما توانایی تولید اندام باردهی (کلاهک) را ندارند. به شبکه سلولی حاصل از یک هاگ که عموماً هاپلوئید (n کوروموزومی) و واجد یک هسته هستند. اصطلاحاً مونوکاریون میگویند. مونوکاریونها معمولاً فاقد توانائی تولید قارچهای بارور هستند.
پنجه دوانی و اتصال هیف ها
از برخورد و تلاقی دو مونوکاریون سازگار با هم، مواد سلولی و ژنتیکی آنها با یکدیگر مبادله می شوند و در نتیجه یک میسلیوم دو هسته ایجاد میشود که قادر به تولید نتاج بارور است به پنجهدوانی یا اتصال شبکهای هیفها یا میسلیومهای سازگار دو هستهای با همدیگر اصطلاح جوش خوردن (اتصال) میگویند. چنین فرآیندی در هر مرحلهای از تولید (آگار، روی اسپان و یا روی بستر کاشت) اتفاق میافتد. تلاقی نژادهای خویشاوند قارچها با هم، مشابه ایجاد گیاهان دورگه در باغبانی است.
کشت هاگ قارچ با رقیق سازی هاگها در محیط کشت
روش دیگر کشت هاگ، ایجاد ایزولههای تک هاگ (انفرادی و رقیقسازی هاگها با مقداری آب مقطر است. محلول هاگ حاصل را میتوان با انتقال آن به ظرف حاوی آب مقطر بیشتری، رقیقتر کرد که به نوبه خود از آن میتوان برای تلقیح نهایی در ظروف کشت استفاده کرد. پرورشدهنده با این روش میتواند هر یک از میسلیومهای جوان تک هستهای را ببیند و یک برنامه زمانبندی تلاقی منظمی را جهت توسعه نژادهای پربازده تدوین نماید.
این روش برای آن دسته از پرورشدهندگانی که مایل به انجام تلاقیهای ساده بین نژادهای تک هسته و مطالعه بر روی خصوصیات نتایج حاصل از تلاقی میباشند ارزش زیادی دارد. توجه کنید که از هر ۱۰۰ گرم هاگ، بهطور متوسط تنها ۱ تا ۵ عدد جوانه میزند و رشد میکنند.
بزرگترین خطر تهدید کننده کشتهای حاوی توده اسپور قارچ چیست؟
بزرگترین خطری که متوجه کشتهای توده اسپوری است، افزایش ضریب آلودگی به ویژه باکتریایی است. بعضی از باکتریها دیواره سلولی میسلیوم ها را مورد حمله قرار می دهند، حال آن که دسته دیگری از آنها باعث تحریک جوانهزنی هاگ در قارچ می شوند تا بعداً میسلیوم آن را مورد استفاده خویش قرار دهند.
از این رو، بعضی از نژادهای خویشاوند، بهطور طبیعی بیمار بوده و آلودگی زیادی در پی خواهند داشت که در صورت جوانهزنی تودههای آنها، احتمال پخش آلودگی در محیط تشدید میشود. بسیاری از قارچها دارای یک رابطه همزیستی مناسبی (میکوریزها) با دیگر موجودات است.
بعضی از باکتریها و مخمرها قادرند جوانهزنی هاگهایی که در شرایط استریل و به تنهایی بسیار مشکل انجام میشود را تسهیل نمایند. اخیراً یک قارچ شناس سوئدی بنام فریس دریافته است که با افزودن مقداری زغال فعال (به میزان دو دهم درصد حجمی) و مخمر قرمز به محیط کشت، میتوان جوانهزنی را تسریع بخشید.
بنا به گزارش بسیاری از پرورشدهندگان، با اضافه شدن عمدی یا تصادفی بعضی از باکتریهای خاص به تعدادی از محیطهای کشت، میتوان رشد و نمو آنها را تشدید کرد. به طور مثال باکتریهای ازتوباکتر، باسیل و نوعی پزئودوموناس، اثر تحریککنندگی بر انواع مختلف قارچ خوراکی و در مراحل مختلف رشد و نمو آنها (جوانه زنی هاگها، رشد میسلیومی، تولید کلاهک) دارند.
در هر صورت بیشتر عوامل باکتریایی و پرورشدهنده در پرورش قارچ با آنها مواجه است، مفید نیست. بطوری که آنها را میتوان زیانبارترین رقیبان قارچ به شمار آورد. با رعایت دقیق نکات بهداشتی، استفاده از صافیهای بسیار ریز (هپا) و فناوری نوین آزمایشگاهی میتوان تا حدی آنها را از محیط حذف کرد.
حفظ خاصیت ژنتیکی قارچ های خوراکی با استفاده از کشت بافت
کشت بافت، روش مطمئنی برای حفظ خاصیت ژنتیکی قارچ خوراکی است که طی آن نمونه بافت زنده را با حفظ خصوصیات والد آن تکثیر میکنند. حال آنکه در کشت هاگ نژادهایی با خصوصیات جدید ایجاد میشوند. نمونه بافت را باید از کلاهکهایی گرفت که ۲۴ تا حداکثر ۴۸ ساعت از برداشت آنها گذشته باشد و چنانچه از این حد فراتر رود، کلاهک خشک شده و یا خیلی پیر میشود در آن صورت، دستیابی به کشت خالص با مشکل همراه خواهد شد.
کشت سالم از کلاهک قارچ ها
با توجه به اینکه، کل کلاهک ترکیبی از میسلیومهای به هم فشرده است. لذا میتوان از هر قسمت آن که بخواهید یک کشت سالم بدست آورید. اما توصیه میشود نمونه را بیشتر از لبه کلاهک یا زیر آن (حد فاصل محل اتصال ساقه تا لبه کلاهک از محل صفحه تیغهها) بگیرید. سپس پوسته کوتیکولی ضخیم روی آن را بردارید و از بافت گوشتی زیر آن نمونه دلخواه را دریافت، سپس سطح آن را با یک پارچه نمدی آغشته به الکل، از هر گونه آلودگی احتمالی پاک نمایید.
بلافاصله بعد از قرار دادن یک تیغ جراحی داغ داخل پتری دیش محتوی آگار (به منظور خنک کردن آن را داخل بافت هیفی قارچ فرو ببرید و قطعه کوچکی از آنرا جدا کنید سپس قطعه جدا شده را به سرعت داخل پتری دیش پر از ماده غذایی منتقل کنید و حتی الامکان بافت و محیط آگار را از تماس با هوا، دور نگاه دارید. این عمل را حداقل برای سه و ترجیحاً پنج ظرف دیگر هم انجام دهید. سپس روی هر ظرف برچسبی حاوی گونه، تاریخ و نوع بافت کشت شده و هم چنین نوع فرمول آگار مصرفی را بزنید. چنانچه این مرحله با موفقیت انجام شود، بعد از ۳ تا ۷ روز میسلیومها جوانه میزنند.
آستانه تحمل آلودگی محیط کشت به باکتریها
آستانه تحمل آلودگی در اکثر سالنهای تولید ۱۰٪ است. با این وجود، معمولاً در کشتهای اولیه که بهطور مستقیم از بافت قارچ وحشی دریافت میشود این مقدار تا ۲۵٪ نیز میرسد که امری عادی است آلودگیهای رنگ به رنگ و مختلفی اغلب در نزدیکی محل بافت انتقالی رویت میشود که تعداد آنها ارتباط نزدیکی با مقدار تمیز بودن بافت یا هاگ های انتقالی و وضعیت بهداشت کل آزمایشگاه دارد. در مجموع در کشت بافت، بیشترین آلودگی را باکتریها ایجاد میکنند.
آلودگی جزء جدایی ناپذیر محیط کشت قارچ است. با افزایش آلایندههای باکتریایی بیش از آستانه تحمل ۱۰٪ مشکلی زود هنگام و دامنهدار در آزمایشگاه بهوقوع خواهد پیوست که باید هرچه زودتر به مبارزه با آن پرداخت.
چگونگی انتقال به محیط کشت دوم
با ظهور علائم رشد در بافت، بایستی آن را به محیط کشت دیگری منتقل کرد که در صورت عدم آلودگی، انتقال سریع لزومی ندارد. اما در صورت تکثیر کلونی کپک در اطراف میسلیوم در حال رشد به سرعت محیط کشت میسلیوم را ایزوله نمایید، تا مبادا مبتلا به کپک گردد.
بدیهی است جداسازی و ایزوله کردن میسلیومها از محیط کشت نیمه آلوده به مراتب از انتقال آنها از یک محیط خالص و سالم سختتر است. زیرا اقدام به جداسازی میسلیوم قارچ از آلاینده نزدیک آن همراه با خطر انتشار و سرایت بیشتر آلودگی است. گذشته از آن، نمیدانیم که زمان برداشتن درب پتری دیش آلوده، هاگهای کپک به بیرون سرایت میکنند یا خیر. بنابراین چنانچه پرورشدهنده هر چه زودتر کشت نیمهآلوده را شناسایی کرده و از شر آن خلاص شود، ایمن نگهداشتن مابقی کشتهای خالص از آلودگی راحتتر میشود.
همچنین به خاطر داشته باشید نژادی که از ظرف آلوده جدا کردهاید میتواند علیرغم ظاهر سالم مملو از آلودگی باشد. تنها در صورت تلقیح آن به بذور استریل در مرحله تهیه اسپان این آلودگی ظاهر میشود. جهت کاهش آلودگی در آزمایشگاه روشهای زیادی وجود دارد که از جمله میتوان به نصب صافیهای بسیار ریز (هپا)، محفظههای شیشهای استریل، سیستم تهویه ملایم هوا، ضدعفونی بودن هوای اتاق، پاکیزه بودن لباس و دستان فرد و غیره اشاره کرد.
در این زمینه(هاگ قارچ چیست؟) به نکات ذیل توجه فرمایید
در مرحله اول، بهترین کار، ضدعفونی محیط کشت، آزمایشگاه، البسه، ابزار، ظروف و بهویژه خود فرد است.
بعد از انجام اعمال مرحله اول باید تمام تلاش خود را صرف حفظ تمیزی آن کنید. تنها کلونیهای سالم را نگهدارید، مابقی ظروف آلوده و حتی نیمه آلوده را از سالن دور کنید.
محیط کشت آگار یکی از مهمترین حلقههای زنجیره کاشت و پرورش قارچ خوراکی است. آگار یک پلی ساکارید با توده مولکولی بالاست که قدرت جذب آب را دارد و آن را معمولاً با غلظت ۰/۸-۰/۶% استفاده مینمایند.
اگر غلظت کمتر شود ( ۰/۴ ٪)، محیط کشت خصوصاً زمانی که PH هم پایین است، سفت نمیشود. و غلظت بالاتر (۱٪) انتخاب شود، محیط کشت خیلی سفت و در نتیجه جذب مواد غذایی توسط باف یا هاگ مشکل میشود.
کشت خالص به منظور تهیه اسپان مورد نیاز برای تکثیر قارچ خوراکی را به دو روش میتوان تهیه نمود. کشت هاگ، که به نوعی میتوان آن را تکثیر جنسی نامید و دارای تفریق صفات و تنوع بالای نتایج حاصله از نظر کیفیت و کمیت محصول است.
آموزش اصلاح نمونه اسپور قارچ
در این ویدیو میتوانید نحوه اصلاح نمونه میسلیوم از اسپور قارچ را مشاهده کنید.
ممکن است اسپور قارچی را در دسترس دارید که قصد داشته باشید از آن محصول قویتر و بهتری بدست بیاورید و تکثیر کنید. با اصلاح نمونه میسلیوم این کار قابل انجام است.
اصلاح نمونه بذر قارچ باعث افزایش پینهای موفق و افزایش اثرگذاری قارچ میشود. هچنین در رشد همزمان قارچها تاثیر مثبتی دارد. هاگ قارچ یا اسپور قارچ چیست؟
مولف:
گردآوری، ترجمه و تحریر از تیم رسانه هاگ
کپی فقط با ذکر منبع مجاز می باشد.
برای آشنایی با اطلاعات پایه قارچ شناسی، با هاگ همراه باشید.







2 پاسخ
چطوری هاگ قارچ را استخراج کنیم؟ روی چی کشتش کنیم؟
لطفا مطلب کشت اسپور را مطالعه کنید. هاگ قارچ از این طریق تولید میشود